科学家揭示植物的光适应与捕光调节机制:光合作用状态转换复合体结构
来源:《科学》
作者:李梅等
时间:2018-06-25
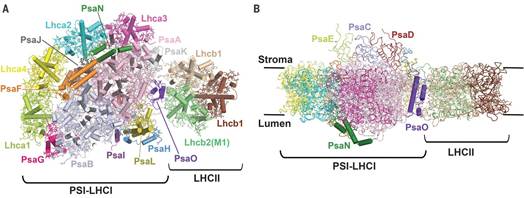
6月8日,《科学》(Science)期刊发表了中国科学院生物物理研究所常文瑞/李梅研究组、章新政研究组的合作研究成果,题为Structure of the maize photosystem I supercomplex with light-harvesting complexes I and II。该项工作首次报道了玉米光系统I-捕光复合物I-捕光复合物II(PSI-LHCI-LHCII)超级复合物的高分辨率冷冻电镜结构,揭示了植物适应自然界多变光照条件,对两个光系统的捕光进行调节,从而平衡能量分配的分子基础。
光合作用为世界上几乎所有的生命体提供赖以生存的物质和能量,放氧光合作用还维持着地球的大气环境。放氧光合生物中的光系统I(PSI)和光系统II(PSII)吸收光能,共同完成光驱动的电子传递,其能量传递和转化效率高达90%以上。由于植物所处的自然环境是不断变化的,植物进化出非常精巧的调节机制,从而最大限度地优化光合作用效率并避免光损伤。对光合作用调节机制的研究不仅具有重要的理论意义,还有着广泛的应用价值,能够为农业上作物的增产抗逆等研究提供结构基础和思路。
状态转换是植物和绿藻中一种重要的光合作用调节机制,由于植物的PSI和PSII的捕光系统色素组成不同,导致对不同能量光的吸收能力不同,从而在自然环境下,受光照条件变化的影响,能量在两个光系统间的分配不均衡。状态转换是植物适应光环境变化、平衡激发能在两个光系统间分配的一种快速响应机制。这个过程是通过PSII上主要捕光天线LHCII的可逆磷酸化,并进而在PSII和PSI间迁移来实现的。当PSII被过度激发时,一部分LHCII会被磷酸化,从PSII上解离下来并结合到PSI上,形成PSI-LHCI-LHCII超级复合物。这部分LHCII作为PSI的外周天线,增加了传递到PSI 反应中心的能量,从而实现了激发能在PSII和PSI之间的平衡分配。解析高分辨率PSI-LHCI-LHCII复合体的结构能够从分子水平上揭示复合物中各个蛋白亚基的排列、PSI和LHCII的相互作用方式以及可能的能量传递途径,进而揭示植物状态转换的分子机理。
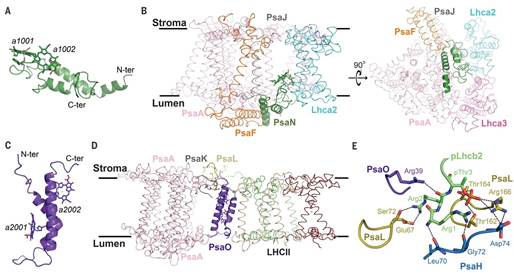
生物物理所的联合研究团队通过密切合作,协同攻关,以最高的效率取得了突破性进展,完成了PSI-LHCI-LHCII超级复合体3.3埃分辨率冷冻电镜结构解析。该复合体是一个约700kDa的膜蛋白-色素复合体,结构精确指认了其中的21个蛋白亚基,定位了202个叶绿素分子,47个类胡萝卜素分子以及众多的其它辅因子(如图)。该工作首次解析了LHCII的N末端磷酸化位点,揭示了LHCII和PSI的相互作用方式,构建了PSI中的全部亚基,包括以往PSI晶体结构中缺失的两个亚基PsaO和PsaN,并发现这两个亚基分别介导了LHCI和LHCII向PSI核心的能量传递。该复合体结构弥补了过去发表的PSI晶体结构中缺失的结构信息及潜在能量传递途径,并为深入研究植物状态转换的分子机理提供了重要基础。该项工作所提供的数据有望启发并促进人工光合作用体系的设计优化等应用研究。
生物物理所研究员李梅和章新政为论文的共同通讯作者,副研究员潘晓伟、马军和苏小东为该项工作的共同第一作者,中科院院士、生物物理所研究员常文瑞以及研究员柳振峰参与了该项研究工作,这也是该团队继过去两年在植物光系统II超级复合物结构研究工作(Nature 2016;Science 2017)发表之后的又一重要突破。该研究工作得到了科技部重点研发计划、中科院B类先导专项、中科院前沿科学重点研究项目、自然科学基金的共同资助。数据收集和样品分析等工作得到了生物物理所“生物成像中心”、生物物理所蛋白质科学研究平台等有关工作人员的大力支持和帮助。(来源:中国科学院生物物理研究所)
Structure of the maize photosystem I supercomplex with light-harvesting complexes I and II
Abstract Plants regulate photosynthetic light harvesting to maintain balanced energy flux into photosystems I and II (PSI and PSII). Under light conditions favoring PSII excitation, the PSII antenna, light-harvesting complex II (LHCII), is phosphorylated and forms a supercomplex with PSI core and the PSI antenna, light-harvesting complex I (LHCI). Both LHCI and LHCII then transfer excitation energy to the PSI core. We report the structure of maize PSI-LHCI-LHCII solved by cryo–electron microscopy, revealing the recognition site between LHCII and PSI. The PSI subunits PsaN and PsaO are observed at the PSI-LHCI interface and the PSI-LHCII interface, respectively. Each subunit relays excitation to PSI core through a pair of chlorophyll molecules, thus revealing previously unseen paths for energy transfer between the antennas and the PSI core.
原文链接:http://science.sciencemag.org/content/360/6393/1109/tab-pdf




