北大学者PNAS发现黄芩为何能治疗肥胖、脂肪肝等疾病的奥秘
来源:《PNAS》
作者:戴建业等
时间:2018-06-25

中药黄芩
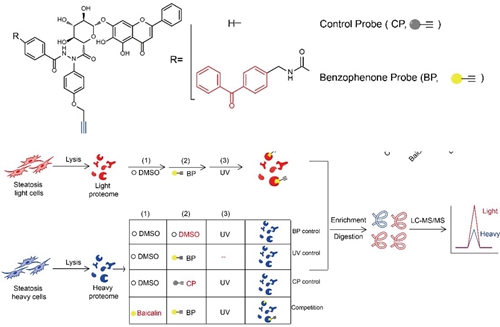
基于黄芩苷探针的化学蛋白质组学流程
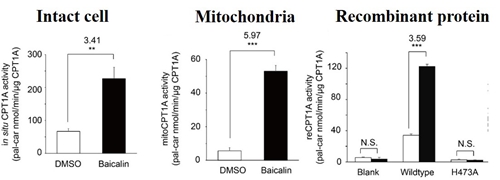
黄芩苷可以直接激活CPT1A的活性
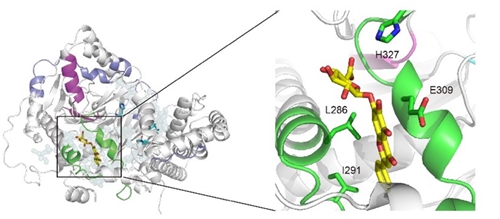
基于分子对接技术预测的黄芩苷-CPT1A复合物模型
北京大学化学与分子工程学院、北大-清华生命联合中心的研究人员以长文形式发表了题为“Chemoproteomics reveals baicalin activates hepatic CPT1 to ameliorate diet-induced obesity and hepatic steatosis”的研究论文,利用定量化学蛋白质组学技术揭示传统中药活性分子黄芩苷治疗肥胖、脂肪肝及其相关代谢疾病的分子机制。
这一研究成果公布在PNAS杂志上,北京大学王初教授为通讯作者,戴建业博士为本文的第一作者。
相对于现代医学,传统中医药凝聚着中华民族几千年的健康养生理念及其实践经验,在很多慢性疾病的治疗中具有较明显的优势。尽管中医药的确切疗效越来越被国际社会所认同,但在分子层面对其药效机制的创新研究却相对薄弱。在中医药现代化的大背景下,王初课题组开发了一系列基于生物质谱的化学蛋白质组学技术,以期为中药药效机制的深入研究提供新的思路。
现今全球约三分之一成年人体重超标,与之相伴随的是较高的与肥胖相关的代谢性疾病风险,包括非酒精性脂肪性肝病、2型糖尿病和心血管疾病等。虽然肥胖的病因和发病机制复杂,但是脂质积聚被认为是罪魁祸首。因此,减少脂质积聚可能是改善肥胖症和相关代谢紊乱的有效解决方案。黄芩是一种被广泛使用的中药材,现代药理学发现其具有抗脂、抗炎以及抗癌等活性,特别是其最主要的活性成分黄芩苷被报道可以改善肥胖及其相关的代谢性疾病,然而其作用机制并不清楚。
王初课题组及其合作者针对这一重要科学问题,通过对黄芩苷分子进行化学衍生化从而获得了与天然黄芩苷具有相似生物活性的光交联分子探针,并利用定量化学蛋白质组学技术来寻找黄芩苷在细胞内的直接药效靶点。
他们发现与黄芩苷相互作用的靶标蛋白在脂肪代谢通路中高度富集,尤其线粒体脂肪酸β-氧化的限速酶CPT1A(Carnitine O-palmitoyltransferase 1, liver isoform)引起了他们的格外关注。通过RNA干扰敲低CPTA的表达水平后,细胞丧失了对黄芩苷降脂活性的响应,暗示这个蛋白是黄芩苷作用机制通路中的一个关键蛋白。接下来,他们通过定量小分子质谱建立了CPT1A的酶活检测体系,结果惊奇地发现黄芩苷可以明显激活CPT1A的活性,从而加速脂肪酸降解的过程。
为了进一步确认黄芩苷与CPT1A的直接相互作用,他们利用计算机辅助的分子对接技术预测了黄芩苷-CPT1A复合物的模型,并通过对结合口袋位点的关键残基进行突变进一步确认了黄芩苷的确是CPT1A别构激活剂。
最后,他们在动物水平上证明了黄芩苷不仅有明显的降脂活性,而且可以有效减轻高脂饮食引起的肥胖和一系列代谢综合征问题,更为关键的是这些效应是依赖于黄芩苷与CPT1A的直接相互作用实现的。
这项研究以威胁人类健康的肥胖及其相关的代谢性疾病为背景,利用先进的定量化学蛋白质组学技术,发现了中药活性分子黄芩苷降脂作用的直接作用靶点CPT1A,从而精细阐述了中药活性分子黄芩苷治疗肥胖及其相关代谢疾病的分子机制。该工作为深入研究中药药效物质基础提供了新的思路,同时也裨益中医药走向科学的进程。(来源:生物通)
Chemoproteomics reveals baicalin activates hepatic CPT1 to ameliorate diet-induced obesity and hepatic steatosis
Abstract Obesity and related metabolic diseases are becoming worldwide epidemics that lead to increased death rates and heavy health care costs. Effective treatment options have not been found yet. Here, based on the observation that baicalin, a flavonoid from the herbal medicine Scutellaria baicalensis, has unique antisteatosis activity, we performed quantitative chemoproteomic profiling and identified carnitine palmitoyltransferase 1 (CPT1), the controlling enzyme for fatty acid oxidation, as the key target of baicalin. The flavonoid directly activated hepatic CPT1 with isoform selectivity to accelerate the lipid influx into mitochondria for oxidation. Chronic treatment of baicalin ameliorated diet-induced obesity (DIO) and hepatic steatosis and led to systemic improvement of other metabolic disorders. Disruption of the predicted binding site of baicalin on CPT1 completely abolished the beneficial effect of the flavonoid. Our discovery of baicalin as an allosteric CPT1 activator opens new opportunities for pharmacological treatment of DIO and associated sequelae.
原文链接:http://www.pnas.org/content/pnas/early/2018/06/06/1801745115.full.pdf




