水稻条纹病毒通过干扰植物蛋白棕榈酰化快速建立侵染
来源:《分子植物》
作者:周雪平等
时间:2018-01-09
水稻条纹病毒(Rice stripe virus, RSV)引起的水稻条纹叶枯病是目前我国以及东亚地区粳稻生产上最严重的病毒病害之一, 最近几十年在我国多次爆发流行。中国农科院植物保护研究所所长周雪平教授带领团队在前期对该病毒的生物学、编码蛋白功能及病毒病防控基础上,进一步深入探索了RSV和寄主植物之间的博弈,发现病毒在与植物共进化过程中精巧地调控植物防御蛋白水平从而帮助病毒快速建立侵染。相关成果在线发表于12月9日的国际知名期刊《分子植物》(Molecular Plant)。
病毒侵染植物时,只有穿过植物细胞之间的通道“胞间连丝”才能在植物细胞间移动,实现对植物的侵染。Remorin蛋白是陆地植物特有的蛋白之一,能够特异定位到细胞膜脂筏上,通过影响胼胝体的积累来调控胞间连丝的通透性,相当于把控胞间连丝孔径大小的大门。
之前的研究发现该蛋白在调控病原物侵染过程中发挥重要作用。相对于真菌和细菌等植物致病微生物,病毒基因组小,结构简单,仅编码数个蛋白,其中病毒编码的运动蛋白能够辅助病毒在细胞间进行移动,那么小小的植物病毒是如何通过运动蛋白敲开植物细胞的通道之门的呢?
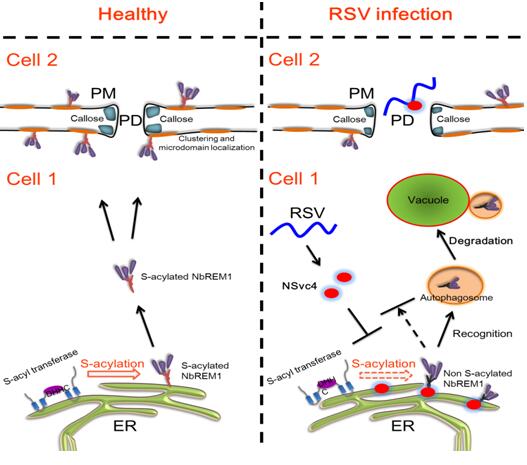
为鉴定参与调控RSV侵染植物的寄主因子以及了解RSV在细胞水平的侵染过程,周雪平团队首先利用iTRAQ蛋白质谱结合病毒诱导的病毒沉默与CRISPR/Cas9体系成功鉴定了一个负调控RSV侵染的寄主因子NbREM1,NbREM1属于remorin基因家族的Group1亚组。研究证实NbREM1通过调控细胞胞间连丝孔径大小抑制RSV的细胞间移动。
利用蛋白定量质谱手段发现NbREM1在病毒侵染的初期蛋白水平显著下调,而转录本水平和对照相比并没有显著的差异,说明RSV侵染可能影响Remorin的翻译后修饰过程。生化分析显示NbREM1蛋白能够被棕榈酰化修饰,而且NbREM1蛋白第206位半胱氨酸是其唯一的棕榈酰化修饰位点。NbREM1的棕榈酰化修饰突变体滞留于植物的内质网以及细胞质中,并诱导细胞自噬途径介导remorin蛋白降解,从而消除remorin对RSV细胞间移动的负调控作用,加速了病毒在细胞间的移动,说明棕榈酰化修饰对于Remorin蛋白的细胞膜定位、蛋白稳定性以及抑制病毒的细胞间移动起到重要作用。
研究发现,RSV侵染后能够干扰Remorin蛋白的棕榈酰化修饰。深入研究显示,RSV编码的运动蛋白NSvc4能够结合Remorin C端棕榈酰化修饰位点区域,干扰其棕榈酰化修饰,导致Remorin细胞膜定位减弱并在内质网大量聚集,诱导细胞自噬并被降解(见附图)。RSV侵染导致Remorin的降解,有利于病毒打开胞间连丝快速进行细胞间的移动。
研究中选取了RSV的两种自然寄主,单子叶寄主水稻和双子叶寄主本氏烟,分别鉴定了两种寄主植物对应的Remorin蛋白,并发现RSV采用类似的手段干扰Remorin的棕榈酰化修饰并通过自噬途径降解该蛋白,减弱其对病毒细胞间移动的抑制。本研究揭示了RSV在和寄主博弈中进化的一种抑制寄主防御的新策略。(来源:科学网 李晨)
Rice Stripe Virus Interferes with S-acylation of Remorin and Induces its Autophagic Degradation to Facilitate Virus Infection
Abstract Remorins are plant-specific membrane-associated proteins, and were proposed to play crucial roles in plant-pathogen interactions. However, little is known about pathogens’ counter-response to remorin-mediated regulation. Here, we find the remorin protein (NbREM1) is down-regulated early in Rice stripe virus (RSV) infection by quantitative whole-proteome analysis. We demonstrate that the turnover of NbREM1 is regulated by the S-acylation modification and can enter the autophagy pathway for degradation. We further show that RSV can interfere with the S-acylation of NbREM1, that is required for negatively regulates RSV infection by restricting virus cell-to-cell trafficking. The interference of NbREM1 S-acylation affects the targeting of NbREM1 to the plasma membrane microdomain, and the resulting accumulation of non-targeted NbREM1 is subjected to the autophagic degradation, causing down-regulation of NbREM1. In addition, we find the RSV-encoded NSvc4 protein alone can interfere with NbREM1 S-acylation through binding with the C-terminal domain of NbREM1. Moreover, we reveal a same counter-response of NSvc4 to the homologous remorin (OsREM1.4) from Oryza sativa, the original host of RSV, indicating down-regulating remorin protein level by interfering its S-acylation is a common strategy that RSV has adopted to overcome remorin mediated inhibition of virus movement.
原文链接:http://www.cell.com/molecular-plant/pdf/S1674-2052(17)30366-0.pdf




