胆红素代谢酶特异性荧光探针底物
来源:《Journal of Medicinal Chemistry》
作者:吕侠等
时间:2017-11-29
近日,上海中医药大学交叉科学研究院的葛广波、杨凌团队研发了一种全新的胆红素代谢酶(UGT1A1,又称尿苷二磷酸葡萄糖醛酸转移酶 1A1)特异性荧光探针底物,并将其用于人肝细胞 / 组织制备物中 UGT1A1 的活性检测以及 UGT1A1 抑制剂和诱导剂的高通量筛选等研究,相关工作在线发表在美国化学会著名学术刊物 Journal of Medicinal Chemistry 上。该论文的通讯作者为葛广波教授和杨凌教授,第一作者为吕侠博士和冯磊博士。
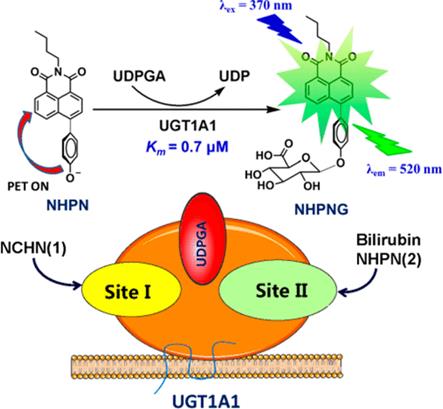
UGT1A1 是一种重要的 II 相代谢酶和肝脏解毒酶,在内源性毒物胆红素的代谢清除和外源物(如抗癌药物依托泊甙及伊立替康的活性代谢产物 SN38 等)的代谢处置中均扮演着非常重要的角色。人体每天会产生 250-350 mg 的胆红素(血红素降解产物),胆红素需先被 UGT1A1 转化成其葡萄糖醛酸化产物(又称间接胆红素),随后方可经胆汁排泄至肠道中。UGT1A1 是人体代谢胆红素的唯一代谢酶,UGT1A1 表达 / 功能的异常偏低可导致胆红素代谢障碍,进而引发高胆红素血症(俗称黄疸);持续性的胆红素代谢障碍可引发胆红素脑病及肝功能异常等症状,严重者会死亡。目前已发现多种临床药物和中草药成分可通过强效抑制 UGT1A1 引发的胆红素代谢障碍和药药相互作用。因此,在药物上市前或多药联合使用(包括中西药联用)时需密切关注药品对 UGT1A1 的抑制作用。
然而,长期以来,生物医药行业一直缺少 UGT1A1 抑制剂的高效筛选与评价方法。胆红素是行业中常用的 UGT1A1 探针底物,但其化学稳定性差(见光易分解)、底物和产物的检测灵敏度低且无法用于高通量。因此,人们迫切需要构建高效、实用且适用于中草药等复杂研究对象的 UGT1A1 抑制作用的筛选和评价体系。2015 年,该团队基于 UGT1A1 的底物偏好性和活性空腔多碱性氨基酸等特征,设计了首个 UGT1A1 比率型荧光探针底物 NCHN(Biosens. Bioelectron., 2015, 72, 261)。但后续研究发现 UGT1A1 具有多个配体结合位点,NCHN 与胆红素的结合位点不同,因此 NCHN 无法完全替代胆红素用于 UGT1A1- 配体的相互作用等研究。该研究中,作者通过对 UGT1A1 底物结合区结构特征和底物偏好性规律的总结,提出通过拓展底物结构提高目标酶特异性的新设想,同时采用新的设计研发策略(光诱导电子转移)设计了一种全新的 UGT1A1 高特异性、高亲和探针底物 NHPN。借助该探针底物,作者开发了基于微孔板的 UGT1A1 酶活高通量检测新方法。该方法具有以下优点:(1)高特异性,可直接用于细胞及组织制备物中 UGT1A1 的活性检测;(2)操作简单且可实现高通量检测;(3)检测灵敏(检测下限可达 0.48 μg/mL),样品需求量小。利用该探针不仅可实现复杂生物样品中目标酶活性的精确检测,还可以通过肝细胞制备物为酶源开展 UGT1A1 调控剂的高通量筛选与表征。此外,NCHN 和 NHPN 还可作为一对不同类型的 UGT1A1 探针底物,用于 UGT1A1- 配体的相互作用,尤其是配体结合位点的鉴定等研究。
上述研究为新药研发及临床药理学研究提供了实用的工具分子和筛选方法,同时也为 UGT1A1 的诱导剂和激活剂的高效发展提供了技术支持。上述研究工作得到国家自然科学基金项目、“重大新药创制”国家重大专项及精细化工国家重点实验室开放课题的支持。此外,大连理工大学的崔京南教授团队以及美国 FDA 的程婕博士等也参与了该研究。(来源:生物360)
A Practical and High-Affinity Fluorescent Probe for Uridine Diphosphate Glucuronosyltransferase 1A1: A Good Surrogate for Bilirubin
Abstract This study aimed to develop a practical and high-affinity fluorescent probe for uridine diphosphate glucuronosyltransferase 1A1 (UGT1A1), a key conjugative enzyme responsible for the elimination and detoxification of many potentially harmful compounds. Several substrates derived from N-butyl-4-phenyl-1,8-naphthalimide were designed and synthesized on the basis of the substrate preference of UGT1A1 and the principle of photoinduced electron transfer (PET). Following the preliminary screening, substrate 2 was found with a high specificity and high affinity toward UGT1A1, while such biotransformation brought remarkable changes in fluorescence emission. Both inhibition kinetic analyses and molecular docking simulations demonstrated that 2 could bind on UGT1A1 at the same ligand-binding site as bilirubin. Furthermore, this newly developed probe was successfully used for sensing UGT1A1 activities and the high-throughput screening of UGT1A1 modulators in complex biological samples. In conclusion, a practical and high-affinity fluorescent probe for UGT1A1 was designed and well-characterized, which could serve as a good surrogate for bilirubin to investigate UGT1A1-ligand interactions.
原文链接:http://pubs.acs.org/doi/ipdf/10.1021/acs.jmedchem.7b01097




