郭房庆研究组Nature子刊解析水稻穗发育细胞命运决定重要机制
来源:《自然植物》
作者:郭房庆等
时间:2018-04-25
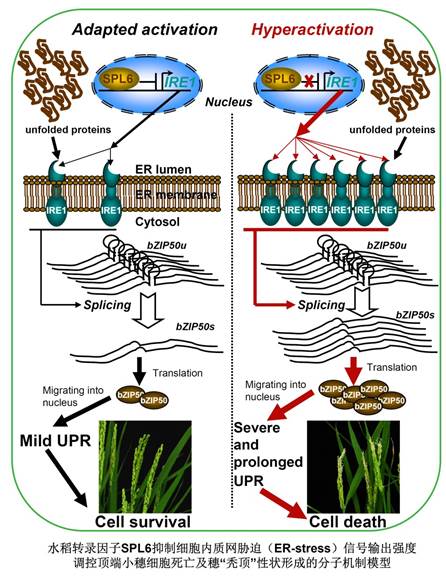
2018年4月10日,国际权威学术期刊《Nature Plants》在线发表了中科院植生生态所郭房庆研究组的最新研究论文,题为“SPL6 represses signaling outputs of ER stress in control of panicle cell death in rice”。研究结果揭示水稻SBP-box家族转录因子SPL6抑制细胞内质网胁迫感应因子(ER-stress sensor)IRE1的转录,控制胁迫信号的输出强度;SPL6在穗发育过程中呈现顶端高水平表达样式,其功能缺失导致IRE1过度表达,造成细胞内质网胁迫信号输出失控和下游基因过激表达,导致顶端小穗细胞衰老退化和穗“秃顶”性状产生。因此,SPL6作为细胞内质网胁迫信号途径的上游调控关键因子,调节胁迫信号输出的时空强度和平衡,进而决定水稻穗发育过程中的细胞存活命运。
水稻穗顶部退化造成的白化现象(俗称“秃顶”)是水稻生产实践过程中一个不利性状,导致每穗谷粒数目显著减少, 结实率显著降低,严重影响水稻产量。育种学家发现水稻穗顶部小穗退化现象受栽培环境条件(如温度和湿度等)的影响。
在破译水稻顶端小穗退化的遗传机制过程中,郭房庆研究组采取了和以往研究者不同的策略和技术路径。通过利用反向遗传学的手段,从高通量筛选和获得水稻穗发育特异表达转录因子基因入手,筛选了一批在水稻穗发育过程中特异表达的转录因子作为重点研究对象。其中发现水稻SBP-box家族转录因子SPL6功能缺失突变体呈现明显的穗顶端退化的“秃顶”表型。
遗传互补实验表明突变体的顶端穗退化表型是由于SPL6突变所导致。细胞学和生化分析显示spl6突变体顶端小穗在正常生长条件下呈现明显的细胞程序化死亡(PCD)特征。在系统分析下游调控靶点基因的基础上,发现spl6突变体顶端小穗细胞内质网胁迫感应因子(ER-stress sensor)IRE1的转录水平及蛋白水平显著增加。多项分子生物学和生化证据表明,SPL6作为转录因子通过特异结合IRE1的启动子,抑制IRE1的表达。
研究人员通过SPL6启动子,组织特异性干扰(RNAi)spl6突变体内IRE1的表达水平,可以部分恢复顶端小穗退化表型,为IRE1高水平表达造成突变体穗“秃顶”性状建立了遗传联系。内质网胁迫感应因子IRE1兼具蛋白激酶和核酸内切酶的活性。突变体中IRE1蛋白的失控性过度累积启动下游靶点基因bZIP50 转录因子mRNA的大量剪切,翻译后的bZIP50蛋白进入细胞核激活其下游调控基因的表达,其中包括大量的PCD相关标志基因,导致细胞在正常生长条件下处于内质网胁迫过激状态,并最终引起细胞衰老退化和穗“秃顶”性状产生。
实验室工作人员王庆龙博士作为论文第一作者承担了大部分的研究工作。该工作得到了中国科学院先导B培育目、国家科技部和国家自然科学基金委员会等项目的资助。(来源:中国科学院植物生理生态研究所)
SPL6 represses signaling outputs of ER stress in control of panicle cell death in rice
Abstract Inositol-requiring enzyme 1 (IRE1) is the most conserved transducer of the unfolded protein response that produces either adaptive or death signals depending on the amplitude and duration of its activation. Here, we report that SQUAMOSA PROMOTER-BINDING PROTEIN-LIKE 6(SPL6)-deficient plants displayed hyperactivation of the endoplasmic reticulum (ER) stress sensor IRE1, leading to cell death in rice panicles, indicating that SPL6 is an essential survival factor for the suppression of persistent or intense ER stress conditions. Importantly, knockdown of the hyperactivated mRNA level of IRE1 rescues panicle apical abortion in the spl6-1 transgenic plants harbouring the IRE1-RNAi constructs, establishing the genetic linkage between the hyperactivation of IRE1 and cell death in spl6-1. Our findings reveal a novel cell survival machinery in which SPL6 represses the transcriptional activation of the ER stress sensor IRE1 in control of ER stress signalling outputs that hinge on a balance between adaptive and death signals for determining cell fates during ER stress.
原文链接:https://www.nature.com/articles/s41477-018-0131-z




