成都生物所王飞团队在发现I型干扰素新型负反馈机制中取得新进展
来源:生物资源利用中心
时间:2025-04-09
近日,中国科学院成都生物研究所王飞课题组在生物化学与分子生物学权威杂志Journal of Biological Chemistry上发表题为“Protein kinase a suppresses antiproliferative effect of interferon-a in hepatocellular carcinoma by activation of protein tyrosine phosphatase SHP2”的最新研究成果,该研究首次揭示了一种I型干扰素信号的新型负反馈调控机制,阐明了蛋白激酶A(PKA)通过激活SHP2抑制JAK/STAT通路,削弱IFN-α的抗肿瘤作用,为提升干扰素在肝细胞癌(HCC)治疗中的疗效提供了潜在靶点和理论基础。
肝细胞癌(HCC)是最常见的原发性肝癌类型,位居全球癌症相关死亡原因的第三位。尽管其主要危险因素,如乙型/丙型肝炎病毒感染、酒精性肝病和非酒精性脂肪性肝炎,已被明确,但由于HCC起病隐匿、进展迅速,大多数患者在确诊时已处于中晚期阶段,治疗选择受限。目前当前的系统治疗手段,如靶向药物和免疫检查点抑制剂,在HCC中的整体疗效有限,且存在广泛的耐药性,导致晚期患者预后仍然较差。
I型干扰素,尤其是IFN-α,因其兼具抗病毒、免疫调节和抗肿瘤增殖等多重作用,曾被广泛用于HCC的辅助治疗,旨在延缓疾病进展并提高患者的生存率。然而,临床研究表明,IFN-α在HCC患者中的治疗效果受限,主要因其毒副作用显著,且有效应答率较低。目前,IFN-α/β通常与传统化疗药物、靶向药物或免疫检查点抑制剂联合应用于临床试验,然而,现有的治疗手段往往仅对一部分患者产生良好反应。因此迫切需要开发新的联合治疗策略,以在更广泛的HCC患者群体中增强对IFN-α的应答效果。
在本研究中,王飞研究员团队发现了一种I型干扰素的新型负反馈调控机制:IFN-α通过激活STAT3/NF-κB信号通路诱导环氧合酶2(COX2)的表达,从而促进前列腺素E2(PGE2)的生成。PGE2进一步激活cAMP依赖性蛋白激酶A(PKA),增强其对SHP2的磷酸化活性。被激活的PKA可通过RACK1/PKA/PDE4D信号复合体促进SHP2与IFNAR2结合,并增强SHP2的磷酸酶活性,从而抑制JAK/STAT通路信号转导,削弱IFN-α的抗肿瘤效应。进一步研究表明COX2抑制剂(如阿司匹林)、PKA抑制剂、SHP2变构抑制剂可显著增强IFN-α介导的JAK/STAT信号通路激活和对HCC细胞的抑制作用。此外,对90例HCC患者样本的分析显示, COX2和磷酸化STAT3(p-STAT3)高表达与HCC的疾病进展及不良预后密切相关。该研究结果不仅揭示了IFN-α疗效受限的潜在机制,也为临床上开发新的IFN-α联合治疗策略以提升其在癌症治疗的疗效提供了重要的理论基础。
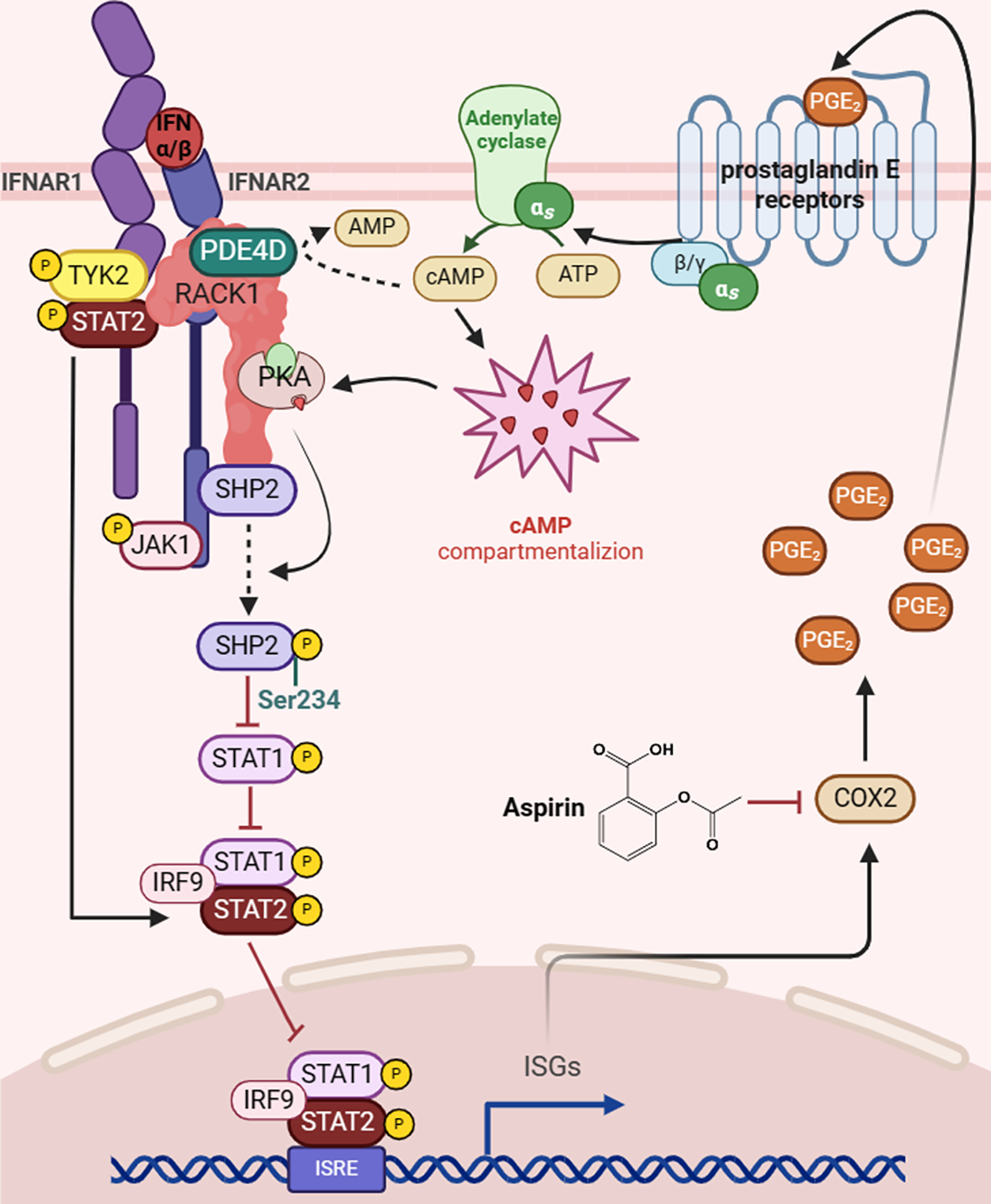
图. PKA/SHP2/STAT1通路示意图
王飞研究员为本论文的通讯作者;成都生物所特别研究助理盛钰雯、博士研究生林源和强喆为本文并列第一作者。该研究得到了国家自然科学基金,中国科学院战略生物资源计划,四川省科技计划等项目的资助。




