乙型肝炎治疗药物开发最新进展
来源:Nature Microbiology
作者:Nikesh Patel等
时间:2017-07-11
6月19日Nature子刊《Nature Microbiology》杂志报道乙型肝炎病毒衣壳形成重要机制,为乙型肝炎治疗新药开发提供了新途径。
世界范围内,乙型肝炎病毒(Hepatitis B Virus,HBV)是造成肝癌的主要原因。认识HBV传播原理是新药治疗之路的基石。
约克大学和利兹大学研究团队发现,HBV遗传物质中含有“汇编代码(assembly code)”,可帮助病毒制造保护性套管(病毒衣壳),方便HBV在其中生产感染性病毒颗粒。
为了将蛋白质组装成特定几何图案,病毒通过RNA生产信号帮助病毒蛋白克服“工程问题”。
约克大学数学生物学家Reidun Twarock教授说:“该结构有点像自行车链条,必须装配在链轮上方能使用,否则就会缠结在一起。正确组装使其与踏板和车轮连接,这些组件才能正常工作。”
“我们发现,HBV信号和病毒蛋白之间发生了类似过程,蛋白质被信号吸引,然后被组装成精确的分子机器,使病毒遗传物质生产复制,从而继续传染。”
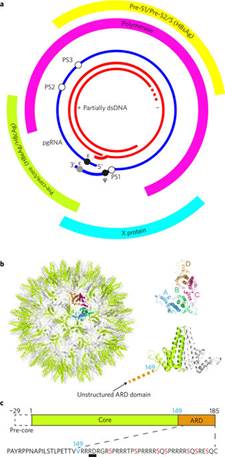
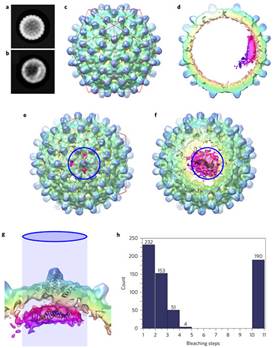
病毒前基因组(pre-genome)和HBV核心蛋白之间存在序列特异性相互作用。利用RNA SELEX(指数富集的配基系统进化技术,Systematic Evolution of Ligands by Exponential Enrichment)技术和生物信息学工具,研究人员确定了前基因组RNA内多个与衣壳蛋白二聚体高亲和区。这些RNA形成茎环结构,拥有环状基本图案保守区,能触发病毒样颗粒(virus-like particles,VLPs)序列特异性组装,从而生产保真度和产量更高的病毒颗粒。在核衣壳装配和前基因组调控过程中,衣壳蛋白-RNA之间沟通模式的重要作用可能不止一个。
HBV病毒通过血液和体液传播。据报道,全球超过20亿人受到感染,约3亿5000万人携带传染性较强的HBV,随着时间推移,终将导致死亡。
HBV在欧洲被发现,但是却在亚洲部分地区盛行,特别是中国和非洲。感染者往往需要昂贵的药物甚至肝脏移植手术来延长生命。
利兹大学结构病毒学教授Peter Stockley说:“有疫苗预防,但是一旦感染,药物虽可减轻症状,却不能改变长期前景。”
“我们经常将HBV与HIV(人类免疫缺陷病毒)进行比较,它们同样是通过人与人之间传播。遗憾的是,HIV还没有特效药物改善生命质量。我们在HBV身上发现了病毒组装原理,今后便可想办法中断RNA信号,扯断病毒生产‘链条’。”
研究人员已经与美国国家卫生研究所展开合作,寻找能打破RNA和蛋白质之间联系、阻止病毒复制的潜在候选药物。(来源:生物通)
HBV RNA pre-genome encodes specific motifs that mediate interactions with the viral core protein that promote nucleocapsid assembly
Abstract Formation of the hepatitis B virus nucleocapsid is an essential step in the viral lifecycle, but its assembly is not fully understood. We report the discovery of sequence-specific interactions between the viral pre-genome and the hepatitis B core protein that play roles in defining the nucleocapsid assembly pathway. Using RNA SELEX and bioinformatics, we identified multiple regions in the pre-genomic RNA with high affinity for core protein dimers. These RNAs form stem-loops with a conserved loop motif that trigger sequence-specific assembly of virus-like particles (VLPs) at much higher fidelity and yield than in the absence of RNA. The RNA oligos do not interact with preformed RNA-free VLPs, so their effects must occur during particle assembly. Asymmetric cryo-electron microscopy reconstruction of the T = 4 VLPs assembled in the presence of one of the RNAs reveals a unique internal feature connected to the main core protein shell via lobes of density. Biophysical assays suggest that this is a complex involving several RNA oligos interacting with the C-terminal arginine-rich domains of core protein. These core protein–RNA contacts may play one or more roles in regulating the organization of the pre-genome during nucleocapsid assembly, facilitating subsequent reverse transcription and acting as a nucleation complex for nucleocapsid assembly.
原文链接:http://www.nature.com/articles/nmicrobiol201798




