细菌与抗癌药物
来源:《Cell》
作者:Aurian P. García-González等
时间:2017-07-04
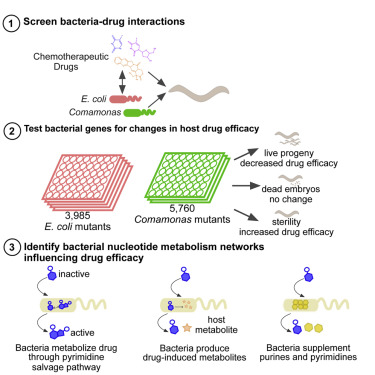
麻省医学院的Marian Walhout博士和其同事们最近在《Cell》上发表文章报道,机体对药物的反应很大程度上取决于肠道微生物的影响。研究人员给模式生物秀丽隐杆线虫(Caenorhabditis elegans,C. elegans)喂食大肠杆菌,后使用氟尿苷(floxuridine,FUDR)对其进行化疗。FUDR也是一种用于治疗大肠癌的常用药。研究表明,大肠杆菌对FUDR的敏感程度是其它细菌的100倍。
长期以来,癌症医生一直困惑着,为什么对患有同一疾病的两个人(即使是拥有同样基因型的双胞胎)使用相同的治疗方法后,会有明显的治疗差异呢?“双胞胎大肠癌患者,虽然遗传物质相同,治疗效果不同是因为他们的肠道菌群各不相同,”系统生物学和分子医学教授Walhout博士说。“如果我们能了解细菌是如何影响化疗药物的药效和毒性的,那么不难想象,我们将建立以益生菌为基础的个性化医疗手段,从而改善某些癌症的临床疗效。”
线虫是一种简单的、透明的遗传学研究模式生物。为了研究不同细菌对抗癌药物的增效或抑制作用,Walhout和同事们首先给线虫喂食了许多种类的特制饲料,再对线虫进行不同的化疗处理(包括FUDR药物处理),最后检测分析线虫的表型和基因型变化。
其中喂食含有大肠杆菌饲料的线虫对FUDR具有极高的药物敏感度,在不同浓度的处理下表现出后代高致死率和完全不育等现象。而喂食从毛单胞菌(Comamonas)饲料的线虫在相同剂量的药物处理后,依然能产出活的幼虫,将FUDR剂量提高100倍后,这组线虫方能表现出与喂食大肠杆菌的线虫相当的药物敏感程度。
在FUDR药物处理下,细菌首先要在肠道存活下来,然后才能代谢药物或是生产代谢产物,从而影响表型和基因型。“由于肠道充满了细菌,”Walhout实验室的研究生Aurian Garcia Gonzalez说。“因此,口服任何药丸都会暴露在这些细菌之中,经过不同细菌的调剂,这些药物的疗效可能就会大不相同了。”
用遗传学技术手段筛选哪些细菌基因能够增加或降低药物药效,了解不同的细菌突变体对FUDR药物治疗效果的影响,让Garcia Gonzalez发现了改进FUDR治疗的分子机制。
“这并非是一个明确的治疗学发现,但是却是一个有意义且相当有趣的研究,”Walhout评价。“将简单的模式生物和强大的基因工具结合起来,我们将开启个性化益生菌药物的开发之门,最大限度地提高某些已知的化疗方法在不同个体身上的治疗效果。”
“这是一种具有可塑性的探索模型:我们向虫子喂食任何细菌,任何药物,然后检测它们的表型和基因型,”Walhout解释道。“这给了科学家们巨大的测试空间以及数以千计的药物和细菌的排列组合,我希望,我们的这项研究能激发更多人来探讨肠道细菌在癌症治疗中的功能和用途。” (来源:生物通)
Bacterial Metabolism Affects the C. elegans Response to Cancer Chemotherapeutics
Abstract The human microbiota greatly affects physiology and disease; however, the contribution of bacteria to the response to chemotherapeutic drugs remains poorly understood. Caenorhabditis elegans and its bacterial diet provide a powerful system to study host-bacteria interactions. Here, we use this system to study how bacteria affect the C. elegans response to chemotherapeutics. We find that different bacterial species can increase the response to one drug yet decrease the effect of another. We perform genetic screens in two bacterial species using three chemotherapeutic drugs: 5-fluorouracil (5-FU), 5-fluoro-2'-deoxyuridine (FUDR), and camptothecin (CPT). We find numerous bacterial nucleotide metabolism genes that affect drug efficacy in C. elegans. Surprisingly, we find that 5-FU and FUDR act through bacterial ribonucleotide metabolism to elicit their cytotoxic effects in C. elegans rather than by thymineless death or DNA damage. Our study provides a blueprint for characterizing the role of bacteria in the host response to chemotherapeutics.
原文链接:http://www.cell.com/cell/fulltext/S0092-8674(17)30375-6




