成都生物所在不对称催化合成手性亚磺酰胺方面取得新进展
来源:天然药物室
作者:李光勋
时间:2019-03-06
手性亚磺酰胺是一类非常重要的化合物,常存在于天然产物、医药中间体中,同时也常用作手性助剂合成手性胺,作为催化剂催化有机反应等。鉴于手性亚磺酰胺重要用途,化学工作者投入了大量的精力对其合成进行研究探索。截止目前,手性亚磺酰胺的合成方法主要是通过拆分,或者利用手性助剂进行非对映选择性合成,采用不对称催化的策略合成手性亚磺酰胺具有重要意义,同时也具有较大挑战。
近日,成都生物所李光勋副研究员与唐卓研究员在该领域的研究取得新进展,该课题组实现了首例不对称催化合成手性亚磺酰胺,如图一所示。以次磺酰胺为底物,双氧水为氧化剂,以手性联萘二酚骨架磷酸为催化剂,充分利用各组分之间的氢键作用成功地合成多种类型手性亚磺酰胺。在该反应中手性磷酸与过氧化氢通过氢键活化增强过氧化氢亲电性,同时,次磺酰胺N-H质子与手性磷酸P=O键氧原子通过氢键作用结合。这种氢键作用使催化剂扮演双重作用,既能活化双氧水,又能固定次磺酰胺,使氧原子选择性的在一面转移,从而以高收率,高对映选择性得到手性亚磺酰胺。该方法克服了传统手性诱导策略合成手性亚磺酰胺的诸多不足:如反应收率低,不符合原子经济效益,底物普适性受限等。
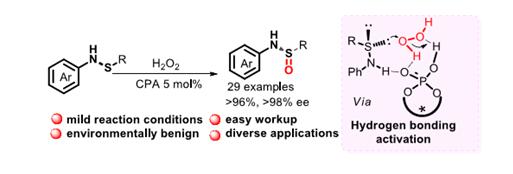
图一:手性亚磺酰胺的首例不对称催化合成
值得一提的是,所得到的手性亚磺酰胺可以通过简单衍生合成多种手性亚砜与手性亚磺酰胺,如图二所示。反应过程中,产物构型翻转,同时收率与对映选择性均能保持很高。
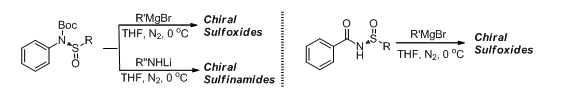
图二:手性亚磺酰胺的衍生合成研究
该研究作为首例不对称催化策略合成亚磺酰胺的方法发表在催化类国际期刊ACS Catalysis, 2019, 9(2), 1525-1530. 该研究得到中国科学院青促会、四川省应用基础研究、四川省创新团队等项目支持。




