雌雄行为差异神经机制研究获进展
来源:《自然—通讯》
作者:许晓鸿等
时间:2018-03-26
1月18日,中国科学院神经科学研究所、脑科学与智能技术卓越创新中心、神经科学国家重点实验室许晓鸿研究组的研究成果,以《小鼠内侧视前区在任一性别个体中都能介导雌雄二样性行为》为题,在线发表在《Nature Communications》上。此项研究首次通过光遗传手段在不同性别的小鼠中同时诱导出雄性求偶行为和母性行为,并通过多种方法证明内侧视前区表达雌激素受体(Estrogen receptor α,Esr1)的神经元在介导雌雄行为差异中起关键作用(如图)。
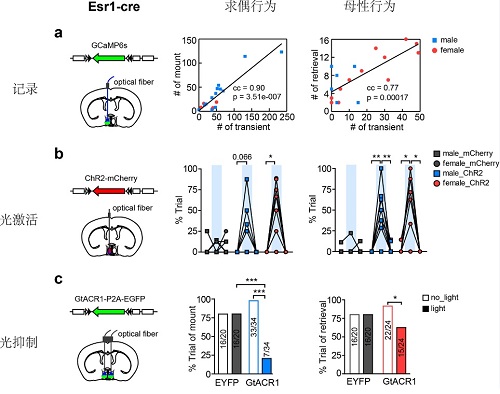
(图片说明:当给予雌性小鼠作为刺激动物,雄性实验动物在行为测试时较雌性实验动物更多地表现出模式化的求偶动作,而当给予幼崽作为刺激,雌性动物在行为测试时则较雄性动物更多地表现出母性行为。a.在Esr1-Cre动物中定位注射Cre诱导表达的编码钙离子指示蛋白(Gcamp6s)的腺相关病毒(AAV),通过光纤记录的方法,研究发现内侧视前核Esr1+神经活动与雄性求偶行为和母性行为的发生高度相关。b.在Esr1-Cre动物中定位注射Cre诱导表达的编码光敏感蛋白(ChR2)的AAV,通过光遗传学手段特异性地激活内侧视前核Esr1+神经元,研究发现在雌雄个体中都可以诱导出类似的雄性求偶行为和母性行为。c.在Esr1-Cre动物中定位注射Cre诱导表达的编码光敏感蛋白(GtACR1)的AAV,在行为发生时通过光遗传学的手段实时抑制Esr1+神经元的神经活动,与对照动物比较,显著性地阻断雄性求偶行为和母性行为的发生。)
在有性繁衍的物种中,雌雄个体在求偶行为和后代照看行为中表现出不同。这些雌雄行为差异在人类和非人灵长类中或由社会因素决定,而在其他物种中则更多反映了神经系统的性别分化和雌雄神经系统的功能不同。内侧视前区(the medial preoptic area, mPOA)位于大脑的底部,下丘脑的前端,在包括人在内的很多物种中均存在显著的雌雄差异,在细胞数目、基因表达以及神经联结等方面雌雄不同,因此内侧视前区一直以来被认为是调控雌雄行为差异的重要脑区。然而,对于内侧视前区的研究长期停留在描述性或损伤性实验上,缺乏精确的功能学层面的研究,因此对于内侧视前核是否调控雌雄行为差异以及其行为调控的神经机制尚不清楚。
为了回答这一问题,许晓鸿课题组利用最新的光遗传学和光纤记录等研究方法,同时在雌雄小鼠中系统性地探究内侧视前核神经活动和性别二样性行为输出之间的关系(如图)。研究发现,内侧视前核神经元,尤其是Esr1+神经元的神经活动和雄性求偶行为和母性行为发生次数高度相关。广谱激活内侧视前核神经元或是特异性地激活Esr1+神经元在雌雄个体中都可以同时诱导出雄性求偶行为和母性行为,表明内侧视前核在任一性别个体中都具有支配任一性别特异性行为的潜能。同时,如果在行为过程中实时阻断内侧视前核Esr1+神经元的神经活动,则可以阻止雄性求偶行为和母性行为的发生。相应的,杀死Esr1+神经元则完全消除雄性求偶行为和母性行为的性别差异。
研究提出性别分化后大脑仍具有双性潜能的假说,并提出内侧视前核Esr1+神经元的性别特异性激活是造成雌雄行为差异的关键因素。此项研究增强了对于内侧视前区功能的了解,也为未来性别二样性行为神经机制的研究提供了理论基础和框架。
研究工作得到了基金委面上项目,科技部青年973计划和中科院交叉创新项目的资助。(来源:中国科学院上海生命科学研究院)
Medial preoptic area in mice is capable of mediating sexually dimorphic behaviors regardless of gender
Abstract The medial preoptic area (mPOA) differs between males and females in nearly all species examined to date, including humans. Here, using fiber photometry recordings of Ca2+ transients in freely behaving mice, we show ramping activities in the mPOA that precede and correlate with sexually dimorphic display of male-typical mounting and female-typical pup retrieval. Strikingly, optogenetic stimulation of the mPOA elicits similar display of mounting and pup retrieval in both males and females. Furthermore, by means of recording, ablation, optogenetic activation, and inhibition, we show mPOA neurons expressing estrogen receptor alpha (Esr1) are essential for the sexually biased display of these behaviors. Together, these results underscore the shared layout of the brain that can mediate sex-specific behaviors in both male and female mice and provide an important functional frame to decode neural mechanisms governing sexually dimorphic behaviors in the future.
原文链接:https://www.nature.com/articles/s41467-017-02648-0




