成都生物所王斌团队在两栖动物洞穴适应机制中获得重要进展
来源:生物多样性保护中心
作者:朱未、卢宁宁
时间:2025-05-03
洞穴生物(例如,洞穴鱼和洞螈)由于栖居于无光、资源缺乏的环境,通常表现出一系列趋同的形态或生理特征,如眼退化、色素缺失、耐饥饿、嗅觉特化等。这些特殊的表型为揭示生物进化的途径和机制提供了独特窗口,也为人类相关疾病(如,神经退行性疾病、代谢疾病等)的研究提供了宝贵线索。
近年来,洞穴鱼类环境适应性研究获得了长足进展,揭示了其永久性色素丢失(TYR和OCA2等色素合成相关基因突变)、饥饿耐受(胰岛素受体和MC4R基因突变)、视觉退化等现象的遗传机制。然而,尽管较少被关注,但在脊椎动物中还存在另一种形式的洞穴适应,即非永久性洞穴适应现象。一个典型的例子是红点齿蟾(Oreolalax rhodostigmatus),该物种主要分布在中国的喀斯特洞穴中。它们在洞穴内产卵,蝌蚪在无光、营养缺乏的环境下发育并变态,表现出真洞穴适应(troglomorphic)的特征——眼睛退化和皮肤透明;在变态高峰期,这些蝌蚪在缺乏光刺激的条件下经历了快速的眼睛发育和色素沉积;变态完成后,个体转变为喜洞(troglophilic)或洞穴客居(trogloxenic)的生活方式,在洞外觅食。总之,红点齿蟾用同一套基因组编码了两种迥异的生活史。最为有趣的是,这一物种洞内与洞外生活阶段不同、甚至相反的需求可能限制了一些洞穴适应的遗传演化路径,其可能采取比永久性洞穴生物更为灵活的洞穴适应策略。
为了揭示这些问题,中国科学院成都生物研究所王斌团队解析了红点齿蟾染色体水平的全基因组和蝌蚪的肠道宏基因组,并从多物种、多种群、多时期、多器官四个层次系统解析了该物种视觉系统、色素系统、消化系统等对洞穴环境的适应策略及其分子基础。主要结论如下:
1、滞后的视觉发育策略——“不鸣则已、一鸣惊人”
功能完善的眼睛通常由晶状体和视网膜等结构共同构成。红点齿蟾蝌蚪的眼睛与洞穴鱼类具有不同的发育命运,后者的眼原基在胚胎发育期间形成,随后晶状体细胞凋亡、视网膜退化。而红点齿蟾在蝌蚪和成体阶段分别具有退化和发育完善的眼睛。在形态水平,蝌蚪在发育早期相对眼径显著小于近源物种(雷山髭蟾);然而,随着发育进程,红点齿蟾蝌蚪的相对眼径逐渐增加,并在Gosner stage 40时与近缘物种近似大小。在分子水平,红点齿蟾蝌蚪功能基因(如rhodopsin、rhodopsin kinase和rhodopsin kinase 1等视网膜基因)的表达远低于近缘物种,提示此时的视觉功能确实处于退化状态;然而,其晶状体蛋白基因却维持着高表达,且随着发育而上调,表明晶状体仍处于持续发育状态。功能发育的“沉默”与结构发育的“活跃”相结合,在降低能量消耗的同时为变态后视觉的“一鸣惊人”提供了基础(图1)。
与蝌蚪时期眼睛的功能退化不同,红点齿蟾在变态发育完成后具有高度发达的视觉,表现为视紫红质的高表达。不仅如此,红点齿蟾成体的视觉系统较近缘物种展现出更高的可塑性,表现为视觉循环(visual cycle)基因转录表达对光线强弱变化的高度可塑性,为其在洞内外环境穿梭提供了基础。此外,红点齿蟾若干光转导通路中的关键基因(如rhodopsin和CNGA1)出现了正选择信号,其他基因(如GRK6和SAG)则表现出快速进化迹象,这些遗传变化可能也参与了红点齿蟾视觉系统对兼性穴居生活的适应。
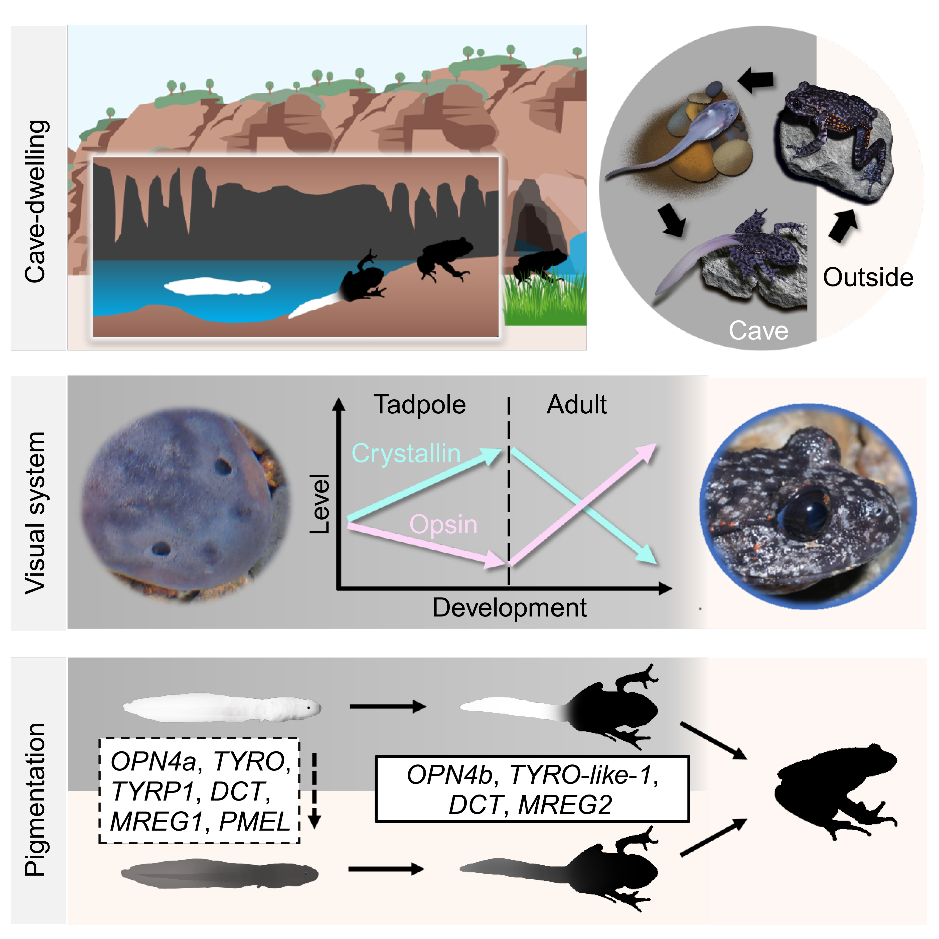
图1 红点齿蟾非永久性洞穴适应的视觉发育策略。
2、弹性的色素策略——“双管齐下”的色素调控
不同于洞穴鱼的可逆性色素丢失,红点齿蟾表现出“随机应变”的色素策略来应对洞内外不同的色素需求。我们在红点齿蟾的基因组中发现了两套相对独立的色素合成系统:光诱导的色素合成系统和发育诱导的色素合成系统(图2)。光诱导的色素合成系统对洞穴的适应表现在MC1R受体(色素合成正调控受体)4个氨基酸的删除突变,导致MC1R本底活性降低、光诱导的活性升高,从而实现“无光下透明、见光后快速黑化”的矛盾色素需求(此前已经报道,Zhu et al., 2018)。发育诱导的色素合成系统的核心元件是一个此次新发现的酪氨酸酶亚家族(TYRO-like;黑色素合成的关键酶),该亚家族仅在两栖动物中存在并表现出快速的扩张;其中,TYRO-like-1在变态发育高峰期(蝌蚪皮肤黑化的高峰期),于背部皮肤、四肢等快速黑化的组织和器官爆发式表达,而在尾部等维持透明表型的器官没有观察到表达上调。发育诱导的色素合成系统在无光条件下诱导色素合成,从而衔接了洞内外两个对色素具有不同要求的生活史阶段。值得一提的是非洞穴近缘物种雷山髭蟾具有TYRO-like-1同源基因,且具有发育诱导的表达模式,提示两栖动物特异性TYRO亚家族的基因扩张为红点齿蟾的洞穴适应提供了前提条件,支持了扩展适应(exaptation)的进化观点。
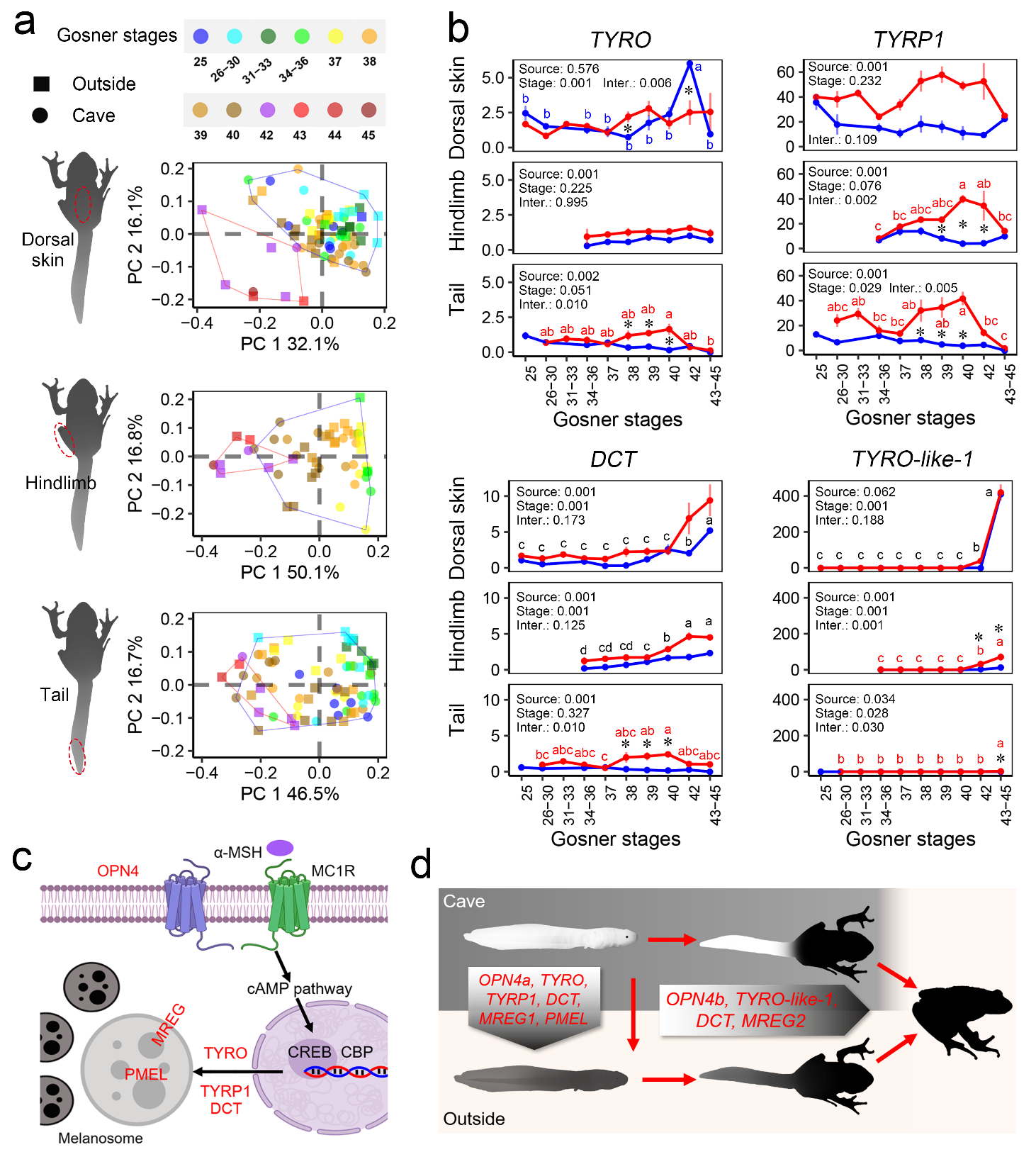
图2 红点齿蟾的色素系统。两套相对独立的色素系统分别参与光诱导的和发育诱导的色素合成。
3、全面的低营养适应策略——“里应外合”
红点齿蟾蝌蚪是我国体型最大的蝌蚪之一,却生长于资源贫瘠的洞穴环境,其适应低营养环境的机制非常有趣。团队从动物自身和肠道菌群两个层面对这一问题展开了研究。
营养的获取。肠道菌群被认为编码了动物的第二基因组,通过营养和免疫途径调节动物的生理行为,其在群落水平的高度可塑性和在物种水平的快速进化特性为宿主适应极端环境提供了一种灵活而有效的方式。研究发现,红点齿蟾蝌蚪在低营养环境下可以富集高丰度的纤维素降解菌(如,Cellulosilyticum、Lactobacillus和Proteocatella)。这些菌群的基因组编码大量参与纤维素降解、植物次生代谢物降解、糖酵解和短链脂肪酸合成的基因,从而将蝌蚪不能利用的资源(尤其是纤维素)转化为可利用的短链脂肪酸(图3),这些菌群在低营养条件下表现出对肠道的保护作用。
营养的存储。在动物自身水平上,红点齿蟾蝌蚪同时利用脂肪体和肝脏储备脂肪,具有典型的“脂肪肝”。与近缘物种相比,红点齿蟾蝌蚪肝脏的高表达基因从血浆蛋白(如胎球蛋白、α-1-微球蛋白和纤维蛋白原)转变为核糖体组分;此外,肝脏载脂蛋白的表达模式表明其肝脏脂肪的代谢更倾向于储存而非动员。这些结果提示红点齿蟾蝌蚪的肝脏从机体的蛋白质“工厂”转变为资源储备器官。在遗传层面,许多参与肝脂代谢(如APO B100、ACOX1和GPAT3)或调控肝脂代谢(如SIRT4和C/EBPα)的基因受到正选择,可能与红点齿蟾肝脏功能的转变有关。
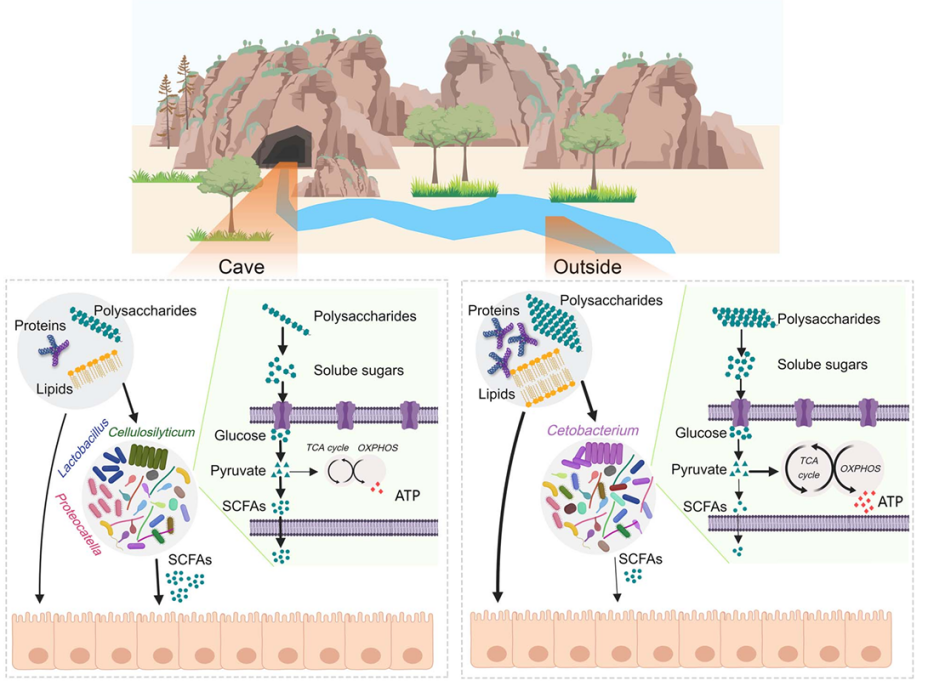
图3 肠道菌群在红点齿蟾低营养适应中扮演重要角色。
以上结论初步揭示了红点齿蟾非永久性洞穴适应的策略和遗传机制。相关成果分别以“Gut microbiota reflect adaptation of cave-dwelling tadpoles to resource scarcity”和“Genome of a stage-dependent cave-dwelling frog reveals the genetic mechanism of an extremely divergent biphasic lifecycle”为题先后发表于The ISME Journal(2024)和Cell Reports(2025)。王斌青年研究员为两篇文章的唯一通讯作者;朱未副研究员和常利明博士为第一篇论文的共同第一作者;卢宁宁博士和朱未副研究员为第二篇论文的共同第一作者;中国科学院成都生物所李家堂研究员和江建平研究员等参与了该项工作,并对本项研究进行了大量指导。以上研究得到了第二次青藏科考项目(2019QZKK05010203)、国家自然科学基金(32070426、32270498、31900327)、中国科学院西部青年学者A类(2021XBZG_XBQNXZ_A_006)等项目的资助。




