成都生物所揭示钙离子通道在癌症免疫治疗中的潜力——抗高血压药物可能成为三阴性乳腺癌免疫治疗的新希望
来源:生物资源利用中心
作者:王飞
时间:2024-12-14
近日,中国科学院成都生物研究所王飞课题组在国际权威学术期刊Advanced Science(影响因子14.3,《期刊分区表》一区TOP期刊)上发表题为“Calcium Channel Blocker Lacidipine Promotes Anti-Tumor Immunity by Reprogramming Tryptophan Metabolism”的研究论文,首次报道了抗高血压药物拉西地平同时靶向钙离子通道(CaV1.2/1.3)和吲哚胺-2,3-双加氧酶1(IDO1)调控色氨酸代谢重编程促进肿瘤免疫治疗的新机制,为三阴性乳腺癌(TNBC)的治疗提供了新的研究思路和临床前证据。该文同时作为亮点文章,被Wiley杂志社旗下的国际科研新闻传播平台Advanced Science News以“Blood pressure drug shown to treat triple-negative breast cancer in mice”为题进行了专门新闻采访报道。
高血压和癌症的发生共享多条生物学途径,包括钙离子通道、氧化应激及慢性炎症反应。电压门控钙通道(VGCCs)在高血压中通过促进血管收缩导致血压升高,而在癌症中异常调控的钙通道则驱动肿瘤细胞增殖、迁移及免疫逃逸。氧化应激和慢性炎症在两者中均引发血管损伤,进一步恶化肿瘤微环境。高血压通过促进血管重塑和血管生成,可能加速肿瘤的生长与转移。因此,高血压不仅是心血管疾病的重要风险因素,也可能在癌症的发生与发展中起到推动作用。另外,在癌症治疗过程中,高血压尤为常见,且与多种治疗方法密切相关。研究表明,约30%-40%的癌症患者在接受化疗或靶向治疗后会发生高血压,尤其是抗VEGF疗法(如贝伐单抗、索拉非尼)引起的高血压发生率可高达40%-50%。因此,高血压不仅是癌症发生和发展的一个危险因素,还可能影响癌症的治疗效果,降低患者的生存质量,但是目前尚不清楚不同类型降压药物在癌症治疗中是否可以实现优化治疗效果、减少治疗相关副作用。
乳腺癌是女性最常见的恶性肿瘤,发病率在不断上升。其中,三阴性乳腺癌(TNBC,Triple-Negative Breast Cancer)是一种最致命的乳腺癌亚型,占所有乳腺癌病理类型的10%-20.8%,具有侵袭性强、易转移、难治疗,预后极差等特点。由于缺乏人类表皮生长因子受体2(HER2)、雌激素受体(ER)和孕激素受体(PR),使得TNBC无法通过传统的激素疗法或HER2靶向治疗进行干预,因此治疗选择受到极大限制。目前针对三阴性乳腺癌缺乏明确有效的治疗手段,暂无获批的靶向药物,化疗是主要的治疗手段,然而,由于TNBC的高度异质性,耐药性和严重副作用,只有约20%的患者有很好的化疗效果,患者的平均总生存期(OS)仅为12至18个月,生存获益有限,治疗策略急需改进。考虑到肿瘤免疫监视对癌症预防的重要性以及三阴性乳腺癌的高免疫原性,免疫疗法正成为治疗三阴性乳腺癌的一种前景广阔的创新疗法。但目前FDA和欧盟仅批准阿替利珠单抗联合白蛋白紫杉醇和帕博利珠单抗联合化疗用于PD-L1阳性三阴性乳腺癌的治疗,尚缺乏对PD-L1阴性或既往接受过PD-1/L1治疗患者的治疗方式。因此,迫切需要开发新的治疗策略,尤其是能够将免疫“冷”肿瘤转化为免疫“热”肿瘤的治疗方法,以增强抗肿瘤免疫反应,提高治疗效果。色氨酸代谢在肿瘤免疫中起着至关重要的作用,主要通过吲哚胺-2,3-双加氧酶(IDO)途径实现。肿瘤细胞通常增加IDO和TDO等酶的表达,导致色氨酸转化为犬尿氨酸的速度加快。这些酶的高活性导致肿瘤微环境中色氨酸的局部耗竭和犬尿氨酸水平的增加。一方面色氨酸缺乏会阻碍效应T细胞的增殖和功能,从而削弱人体免疫系统对癌细胞的免疫反应。另一方面犬尿氨酸及其代谢物也会通过促进免疫抑制的调节性T细胞(Tregs)和骨髓来源抑制性细胞(MDSCs)的积聚,增强免疫耐受,促使肿瘤逃避免疫监视。因此,IDO作为癌症免疫治疗的潜在靶点,开发其新型抑制剂将可能通过调控肿瘤微环境中的色氨酸代谢恢复局部免疫反应、解除免疫抑制,从而增强肿瘤免疫治疗的疗效。
拉西地平(Lacidipine)是一种二氢吡啶类钙离子通道阻滞剂(CCBs),常用于治疗高血压,通过抑制L型钙通道(CaV1.2/1.3)来降低血压,具有较长半衰期和较小副作用。王飞研究员团队通过研究发现拉西地平是一种IDO1的双功能调节剂,不仅能够直接抑制IDO1的酶活性,还通过靶向钙离子通道阻断钙依赖的Pyk2-JAK1-calmodulin复合物的形成,进一步抑制JAK/STAT及NF-κB信号通路介导的IDO1转录激活。拉西地平通过调控色氨酸代谢重编程有效减少了犬尿氨酸的积累,同时保持细胞内总NAD+的水平稳定,从而显著增强CD45+CD8+效应T细胞的活性并削弱了CD4+CD25+Foxp3+Tregs的免疫抑制能力,将“冷”肿瘤转化为“热”肿瘤。此外,在小鼠乳腺癌肿瘤免疫模型中,与化疗药物顺铂或多柔比星单独使用相比,联合使用拉西地平表现出更优异的抗乳腺癌和肿瘤免疫调节作用。进一步通过分析136例乳腺癌临床组织标本,发现与癌旁正常组织相比,肿瘤组织中IDO1的表达量显著升高,且与Pyk2的磷酸化水平呈正相关,表明IDO在乳腺肿瘤组织中的表达量可能是拉西地平治疗TNBC的一个潜在生物标志物。该研究首次揭示了钙通道在IDO1介导的色氨酸代谢过程中对肿瘤免疫的新功能,从而为TNBC的一线治疗提供了一种即时可用的免疫治疗新策略。以拉西地平为代表的CCBs作为目前临床主要使用的降压药,该研究不仅为伴发高血压的肿瘤患者提供全新的治疗策略,也为联合化疗开展三阴性乳腺癌及其他难治性肿瘤的治疗提供了新的理论依据和临床应用前景。
王飞研究员为本论文的通讯作者;成都生物所博士后盛钰雯为第一作者。该研究得到了国家自然科学基金、中国科学院战略生物资源计划、四川省自然科学基金和中国科学院成都生物研究所攻关团队项目等的支持。
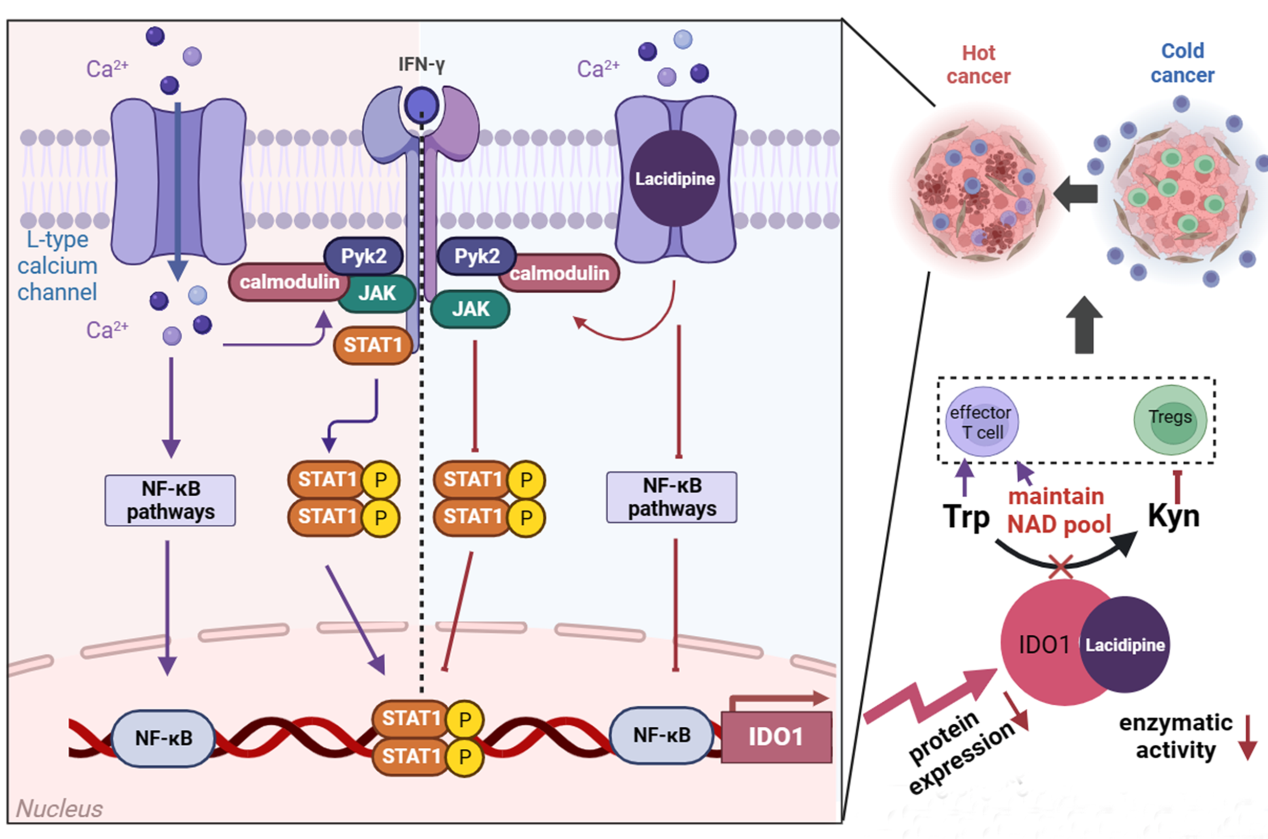
图. 拉西地平作用机制示意图
该论文链接:http://doi.org/10.1002/advs.202409310




