成都生物所在Bt杀虫蛋白空间结构稳定性研究中获进展
作者:赵文强
时间:2023-08-14
苏云金芽孢杆菌(Bacillus thuringiensis, Bt)杀虫晶体蛋白在近几十年广泛应用于农业生产,目前全球80%的棉花和32%的玉米为转基因植物,世界各地农民共种植超过9800万公顷的转基因玉米、棉花和大豆。Bt转基因作物通过植物残体分解或根系分泌物途径向土壤中释放大量Bt杀虫蛋白,这些蛋白质紧密吸附在土壤颗粒表面,在一定时间段内对目标害虫抗性和非目标土壤生物产生潜在影响。
有研究表明,进入到土壤中的吸附态Bt蛋白可在几天或数周内失去杀虫作用,而土壤中的朊病毒能维持其传染性达数年之久。一般来说,土壤界面上的吸附态蛋白可抵御微生物降解作用,因此前人推测可能是界面理化过程导致Bt蛋白空间结构发生变化,进而降低其生物学活性。近年来,前人采用傅里叶变换红外光谱(FTIR)和石英晶体微天平技术(QCM-D sensor)模拟了Bt蛋白在矿物/金属表面的NH/ND交换动力学过程以及供应率依赖特征,通过间接证据证实杀虫蛋白在界面吸附过程中维持了较高的二级结构稳定性和生物活性。然而,这些分子水平上的半定量手段(如α-螺旋和β-折叠)无法全面探究蛋白质的宏观结构稳定性,且无法解释Bt蛋白的生物活性为何在实际土壤中维持较短时间。
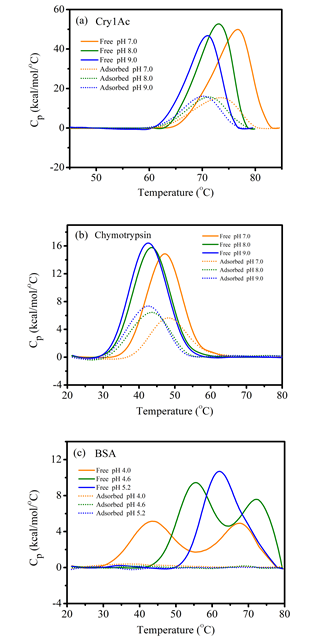
为此,本研究运用差示扫描量热法(Differential scanning calorimetry, DSC)对吸附态和游离态Bt蛋白(以Cry1Ac为例)的结构热稳定性进行定量,同时以牛血清蛋白(bovine serum albumin - BSA,空间结构不稳定的“软”蛋白)和糜蛋白酶(chymotrypsin,空间结构较稳定的“硬”蛋白)作为参照物,探讨不同pH条件下Cry1Ac的界面吸附作用和空间结构变化特征。DSC技术可测定不同温度下蛋白质的excess heat capacity (Cp, kcal/mol/°C),计算出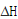 (焓变)、变性温度、FWHM(半峰转变宽度)等参数来表征蛋白质的宏观结构稳定性。
(焓变)、变性温度、FWHM(半峰转变宽度)等参数来表征蛋白质的宏观结构稳定性。
结果表明,蒙脱石矿物表面吸附态的Cry1Ac空间结构变化程度更接近“硬”糜蛋白酶,而不是“软”BSA,原因如下:(i)Cry1Ac吸附在蒙脱石上后,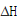 焓变值下降了62.5%-67.5%,与糜蛋白酶
焓变值下降了62.5%-67.5%,与糜蛋白酶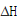 下降的百分比(55.1%-61.6%)相当(图1),即有序空间结构损失率相当,Cry1Ac和糜蛋白酶在吸附状态下都发生部分结构变性;(ii)吸附态Cry1Ac和糜蛋白酶的FWHM值变化都较小(<0.5 oC),空间结构均一化程度较高;(iii)各pH条件下Cry1Ac和糜蛋白酶的吸附趋势与DLVO理论预测保持一致,这可能是由于相似的吸附作用力机制与空间结构变化程度所致;(iv)相反,“软”BSA吸附后完全变性,有序空间结构被完全破坏,且pH介导下的矿物界面吸附特征偏离于DLVO理论。
下降的百分比(55.1%-61.6%)相当(图1),即有序空间结构损失率相当,Cry1Ac和糜蛋白酶在吸附状态下都发生部分结构变性;(ii)吸附态Cry1Ac和糜蛋白酶的FWHM值变化都较小(<0.5 oC),空间结构均一化程度较高;(iii)各pH条件下Cry1Ac和糜蛋白酶的吸附趋势与DLVO理论预测保持一致,这可能是由于相似的吸附作用力机制与空间结构变化程度所致;(iv)相反,“软”BSA吸附后完全变性,有序空间结构被完全破坏,且pH介导下的矿物界面吸附特征偏离于DLVO理论。
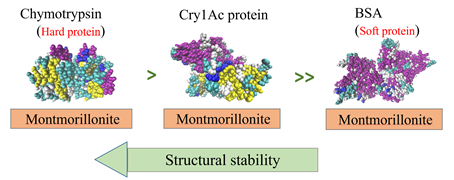
总体上,范德华力、位点控制静电引力(PCEA)、疏水效应和蛋白质去折叠过程中的熵增加均有助于Cry1Ac在蒙脱石上的吸附。Cry1Ac的结构稳定性略低于“硬”糜蛋白酶,但远高于“软”BSA(图2),这可能是对其杀虫特性在土壤中保留时间较短的合理解释。Bt蛋白Cry1Ac进入土壤后短期内的空间结构损失和活性下降可以减少非目标土壤生物的暴露风险,但同时也会影响转基因作物将Bt毒素输入土壤后的环境监测和生态风险评价过程。
本研究于2023年3月以“pH-Dependent Changes in Structural Stabilities of Bt Cry1Ac Toxin and Contrasting Model Proteins following Adsorption on Montmorillonite”为题发表于《Environmental Science & Technology》,赵文强副研究员为论文第一作者,法国农业科学研究院Siobhan Staunton教授和Hervé Quiquampoix教授为共同通讯作者。
图1 不同pH条件下自由态和吸附态(a)Cry1Ac(Bt杀虫蛋白)、(b)chymotrypsin(糜蛋白酶)以及(c)BSA(牛血清蛋白)的DSC热图
图2 Cry1Ac杀虫蛋白在蒙脱石表面的结构稳定性略低于“硬”糜蛋白酶,且远高于“软”牛血清蛋白,吸附态Cry1Ac蛋白中等强度的空间结构损失可能是其杀虫活性在土壤中保留时间较短的重要原因