三萜天然产物广谱抑制病毒感染的作用靶点和机制
来源:《科学进展》
作者:Si Longlong等
时间:2018-12-13
北京大学周德敏、张礼和研究团队发现三萜天然产物广谱抑制流感、埃博拉和HIV病毒感染的共性作用靶点和机制,成果“Triterpenoids manipulate a broad range of virus-host fusion via wrapping the HR2 domain prevalent in viral envelopes”发表在SCIENCE子刊《Science Advances》上,有助于揭开传统中药抗病毒的神秘面纱。
引发流感、艾滋病、埃博拉出血热等致命性传染病的病毒时刻危害着人类健康,缘于人类对病毒认识的局限,限制了相关抗病毒药物的研发。我国拥有悠久的中草药历史,在数千年的文化传承和历史积淀过程中,收录并记载了许多如板蓝根、柴胡、葛根等与抗病毒功能相关的天然中草药。
周德敏、张礼和研究团队长期关注相关研究,这样的中药是否具有抗病毒活性?如果有,其抗病毒的物质基础是什么?基于这样的物质基础能否促进人类对病毒感染过程及调控的认识,甚至开发出新型抗病毒药物?
为回答以上问题,该团队集中于病毒-宿主细胞识别、膜融合过程,借助于中药所富含的天然产物,发现了三萜天然产物广谱抑制流感、埃博拉和HIV等病毒感染的共性作用靶点和机制,有助于新型抗病毒药物的研发。
三萜是一类以疏水五环骨架为特征的次生植物代谢物,通常认为是植物防御病原体感染的重要化学成分,广泛存在于自然界,也推测是民间药物中具有重要生物活性的成分,但其真实性及分子机制尚待阐明。
周德敏、张礼和研究团队基于团队和他人发现的齐墩果酸、合欢酸、白桦脂酸等三萜天然产物拮抗流感病毒和HIV病毒感染的工作基础,最新发现这类物质同样抑制埃博拉病毒的感染。
为了揭示这类三萜天然产物广谱拮抗病毒感染的作用机制,该团队以三萜先导物为母核、以构效关系为引导,巧妙设计了末端兼带炔基和光交联基团的可溶性分子探针,继而与病毒/细胞培养液共孵育、光照激活,实现了三萜探针与靶蛋白共价交联,之后通过与含叠氮基团的生物素Click反应,最后捕获、富集和质谱组学证实交联蛋白为病毒膜蛋白。
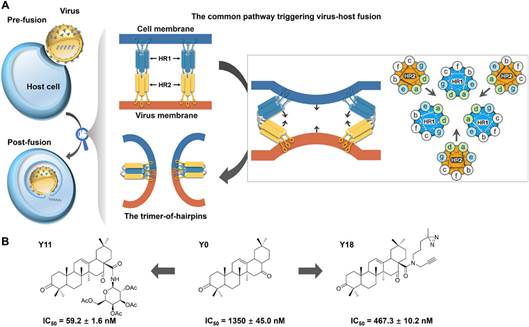
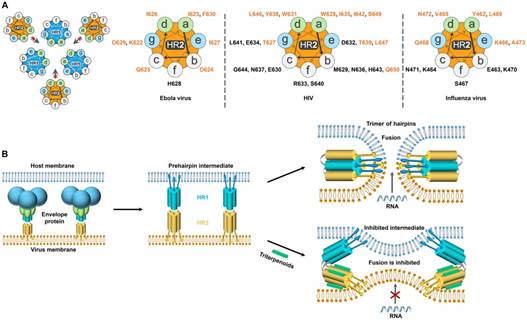
更进一步研究人员对三萜先导物-病毒蛋白复合物进行氨基酸替换、SPR和核磁共振综合分析,解析出三萜先导物结合到一个称为HR2的七肽片段,并覆盖其螺旋构型表面。HR2是包括流感、埃博拉和HIV病毒等I型RNA病毒膜蛋白所高度保守的α螺旋样序列,其通过与相邻的、由另一个高度保守的呈α螺旋样序列HR1相互作用形成HR1-HR2三聚体发夹状结构,拉近病毒与细胞膜进而促进其融合。
三萜化合物正是通过其疏水五环骨架覆盖在HR2螺旋表面,阻碍了病毒-细胞膜融合所依赖的、HR1-HR2亲和导致三聚体发夹状结构形成这一保守路径,从而表现出广谱的抗病毒活性,也使HR2从被认为是一个“undruggable target”变为“druggable target”,为抗病毒药物的研发提供了新的作用靶点和先导结构。
病毒在组成、结构和复杂性方面存在显著差异,生命进化史上的起源也不清楚。三萜天然产物的广泛存在,特别是其通过结合病毒膜蛋白HR2赋予植物宿主自我化学防护功能,提示三萜类天然物可能是大自然调控病毒与宿主识别的进化产物,为“病毒家族从一个共同祖先进化而来”的学说提供有力的支持,也有助于揭开传统中药抗病毒的神秘面纱。
我国中草药资源丰富,其中含有丰富且结构多样的酚类、多酚类、单宁类、萜烯类和生物碱等天然产物,均是长期的生物进化和自然选择的结果。基于传统中草药所含的天然产物的化学生物学研究,有可能是探讨生命本质、认识疾病的发生发展过程、进而发现先导药物的重要途径。
博士研究生司龙龙为本论文的第一作者,北京大学药学院天然药物及仿生药物国家重点实验室为通讯单位。该工作获得了基金委、科技部多个基金项目的支持。(来源:北京大学)
Triterpenoids manipulate a broad range of virus-host fusion via wrapping the HR2 domain prevalent in viral envelopes
Abstract A trimer-of-hairpins motif has been identified in triggering virus-cell fusion within a variety of viral envelopes. Chemically manipulating such a motif represents current repertoire of viral fusion inhibitors. Here, we report that triterpenoids, a class of natural products, antagonize this trimer-of-hairpins via its constitutive heptad repeat-2 (HR2), a prevalent α-helical coil in class I viral fusion proteins. Triterpenoids inhibit the entry of Ebola, Marburg, HIV, and influenza A viruses with distinct structure-activity relationships. Specifically, triterpenoid probes capture the viral envelope via photocrosslinking HR2. Profiling the Ebola HR2-triterpenoid interactions using amino acid substitution, surface plasmon resonance, and nuclear magnetic resonance revealed six residues accessible to triterpenoids, leading to wrapping of the hydrophobic helix and blocking of the HR1-HR2 interaction critical in the trimer-of-hairpins formation. This finding was also observed in the envelopes of HIV and influenza A viruses and might potentially extend to a broader variety of viruses, providing a mechanistic insight into triterpenoid-mediated modulation of viral fusion.
原文链接:http://advances.sciencemag.org/content/4/11/eaau8408/tab-pdf




