关于CRISPR-Cas9制造转基因物种的安全性问题
来源:《PNAS》
作者:Hidenori Tanaka等
时间:2017-08-22
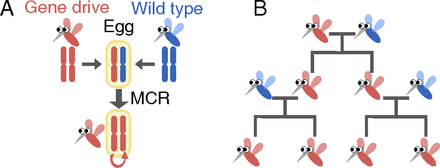
假设,你现在有一只转基因抗疟疾蚊子准备投放出去,你准备怎么办?
总共需要多少转基因蚊子才能替换掉携带病毒的野生型?
如何分销最有效果?
如何阻止转基因蚊子的过早泄漏?
将基因工程生物放到野外环境是否会对生态系统造成不可逆转的伤害?
对许多没经历过现场调查的研究人员来说,如何回答以上问题?
哈佛大学和普林斯顿大学的应用数学和物理学家们设计了一款数学模型,从取代野生蚊子的效率和安全控制等方面指导转基因的释放。文章最近发表在《PNAS》杂志。
自然物种进化选择时期,任何特定性状注定只有一小部分能被后代遗传。但是,现如今,拜CRISPR-Cas9基因编辑技术所赐,实验工作者设计添加任意理想遗传性状的可能性接近100%,哪怕这种性状存在明显的自然选择性缺陷。试想,有一天,这些所谓的gene drive(利用遗传偏好,将基因快速扩散到群体中的一种体系)能在短时间内取代野生型基因。
CRISPR-Cas9这种强大的基因编辑系统引发了严重的安全问题。比如,你很难想到基因工程蚊子意外逃离实验室后会引发什么?
哈佛大学工程学院应用科学和物理系的一名研究生Hidenori Tanaka认为,偶然或过早地把gene drive产品释放到自然环境,势必会不可逆转地破环生态系统。
于是,为了防止类似事件,Tanaka联合了David Nelson、Howard Stone等文中作者,提出了一个窄范围的基因扩散后选择不利因素,和允许基因扩散的临界阈值。
研究人员利用非线性反应扩散方程模拟基因在空间内的运动。这些模型为开发有社会责任感的gene drive提供了一个可供参考的框架,使转基因性状与嵌入的弱点相平衡,防止意外释放和不可控扩散。
“实际上,只有当接种参数超过我们能预测的临界值时,我们才可以创建启动或终止gene drive的传播,”Tanaka说。
研究人员计算发现,人工基因需要在特定区域被大量释放,而不是在整个大区域内稀疏扩散,这个特点类似爆破原理,只有当基因释放中心超过临界尺寸和临界强度时,一种外源基因才会传播。
研究人员还发现, gene drive产品容易受对野生型基因无害的化合物的影响,转基因生物的扩散可通过农药等障碍进行阻止。
这篇文章说明,物理学家和应用数学家们也正在利用生物学家们的实验和理论知识,为空间种群遗传学的发展做贡献。
学科间的合作互惠也许能让人类在“改造自然”这件事儿上,少走点弯路。
下一步,这个应用数学物理团队还准备进一步了解基因突变类型和生物群体数量变化对gene drive系统的直接或间接影响。(来源:生物通)
Spatial gene drives and pushed genetic waves
Abstract Gene drives have the potential to rapidly replace a harmful wild-type allele with a gene drive allele engineered to have desired functionalities. However, an accidental or premature release of a gene drive construct to the natural environment could damage an ecosystem irreversibly. Thus, it is important to understand the spatiotemporal consequences of the super-Mendelian population genetics before potential applications. Here, we use a reaction–diffusion model for sexually reproducing diploid organisms to study how a locally introduced gene drive allele spreads to replace the wild-type allele, although it possesses a selective disadvantage s > 0. Using methods developed by Barton and collaborators, we show that socially responsible gene drives require 0.5 < s < 0.697, a rather narrow range. In this “pushed wave” regime, the spatial spreading of gene drives will be initiated only when the initial frequency distribution is above a threshold profile called “critical propagule,” which acts as a safeguard against accidental release. We also study how the spatial spread of the pushed wave can be stopped by making gene drives uniquely vulnerable (“sensitizing drive”) in a way that is harmless for a wild-type allele. Finally, we show that appropriately sensitized drives in two dimensions can be stopped, even by imperfect barriers perforated by a series of gaps.
原文链接:http://www.pnas.org/content/early/2017/07/24/1705868114.full.pdf




